약효 좋고 부작용 적고…신약R&D, 바이오 의약품에 꽂히다
2018-04-04 11:41
의약품 비중 매년 9.4% 성장 전망10년간 FDA 승인 신약 40% 차지
국내제약사들 ‘바이오시밀러’ 성공
축적된 기술력 바탕 개발 본격화
세계 의약품 시장에서 신약 연구개발(R&D) 중심이 합성의약품에서 바이오의약품으로 이동하고 있다. 바이오의약품은 합성의약품에 비해 약효가 우수하고 부작용이 적은 장점이 있다. 더구나 임상시험에서 상업화까지 가는 전체 신약개발 성공률도 합성의약품에 비해 상대적으로 높아 글로벌 빅파마들의 연구개발 방점은 바이오의약품에 찍히고 있다.
한국은 아직 바이오의약품 연구개발에 있어 걸음마 단계에 있지만 바이오의약품의 한 분야인 바이오시밀러 개발이 활발히 진행되면서 축적된 기술력을 바탕으로 향후 바이오의약품 개발에 있어서도 성과를 낼 것으로 기대된다.
▶덩치 커지는 바이오의약품 시장=바이오의약품은 사람이나 다른 생물체에서 유래된 원료 또는 재료로 제조한 의약품을 말한다. 생물학적제제, 유전자재조합의약품, 세포치료제, 유전자치료제, 동등생물의약품(바이오시밀러), 개량생물의약품(바이오베터) 등이 포함된다.
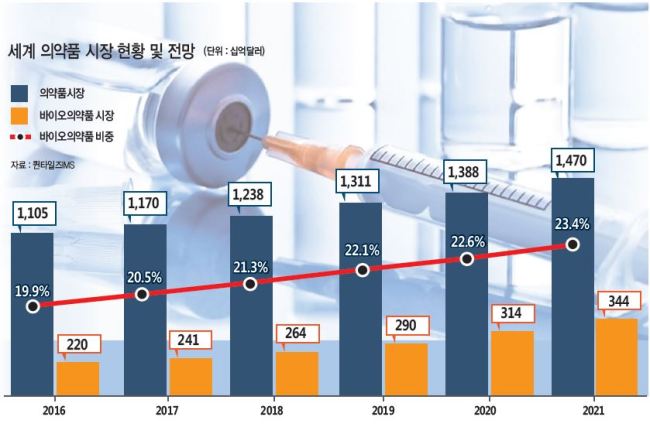
의약품 시장조사기관 퀸타일즈IMS 자료에 따르면 2016년 기준 세계 의약품 시장규모는 2016년 1조1050억달러다. 이 중 바이오의약품 비중은 2220억달러로 19.9%를 차지했다.
하지만 바이오의약품 시장 규모는 향후 5년간 연평균 9.4% 성장이 예상되면서 오는 2021년에는 세계 의약품 시장에서 23.4%에 해당하는 3440억달러까지 성장할 것으로 보인다.
이는 바이오의약품이 합성의약품에 비해 가지는 장점이 많기 때문이다. 바이오의약품은 일반적으로 합성의약품에 비해 약효가 우수하고 부작용이 적다. 때문에 임상시험에서부터 신약 승인에까지 가는 전체 신약개발 과정의 성공률이 높다.
보통 1개의 신약개발을 위해서는 평균 14년의 시간이 필요하다. 후보물질 발굴에만 4.5년이 걸리고 비임상 시험에 1년, 임상 1상에서 1.5년, 2상과 3상에 각각 2.5년이 소요된다. 이후 승인신청에서 시장 출시까지 또 다시 1.5년이 추가된다.
이런 단계별 성공률을 분석해봤을 때 임상 1상에서 신약 승인까지 합성의약품의 성공률은 6.2%에 그치지만 바이오의약품 성공률은 그보다 2배 정도 높은 11.5%로 나타났다.
▶FDA 승인 신약 중 40%가 바이오신약=이에 최근 10년간 미 FDA의 신약 승인을 받은 의약품 중에도 바이오의약품의 비중은 갈수록 높아지고 있다. 지난 2008년부터 2017년까지 10년 동안 FDA의 승인을 받은 신약은 총 321개다. 이 중 바이오신약은 71건이 승인을 받아 40%에 육박하는 것으로 나타났다. 특히 바이오신약의 승인 비중은 해가 갈수록 높아졌다.
지난 2008년 FDA 승인 신약 24개 중 합성신약은 21개인 반면 바이오신약은 3개로 14.3%에 그쳤다. 하지만 2010년 총 21개 승인 신약 중 6개가 바이오신약으로 40%를 차지했다. 이후 2011년 25%(30개 중 6개), 2012년 18.2%(39개 중 6개), 2013년 8%(27개 중 2개)까지 떨어졌지만 2014년부터는 30%를 회복했다.
2014년 전체 승인 의약품 41개 중 11개가 바이오의약품으로 36.7%를 차지했고 2015년에도 전체 45개 중 12개로 36.4%를 차지했다. 특히 2016년에는 22개 신약 중 7개가 바이오신약으로 46.7%까지 높아졌고 2017년에도 전체 46개 신약 중 12개가 바이오신약이었다. 2014년부터 2017년까지는 거의 매년 두 자릿수의 바이오신약이 허가를 받으며 전체 승인 신약 중 35% 이상의 비중을 차지하고 있는 것으로 나타났다.
업계 관계자는 “아직 개발되는 전체 신약 중 합성의약품의 수가 많기는 하지만 해가 갈수록 개발되는 신약 중 바이오의약품 비중이 갈수록 커지고 있다”며 “업계에선 합성의약품 시대가 저물고 바이오의약품 시대가 온다는 얘기가 나오고 있다”고 말했다.
▶국내사는 아직 초기 단계…바이오시밀러로 기술력 축적 중=전 세계적으로 주목을 받고 있는 바이오의약품이지만 아직 국내 제약사들은 본격적인 개발에 나서고 있지 못하다. 합성의약품에 비해 신약 성공률이 높다지만 아직 그 많은 신약개발 비용을 감당하기엔 부담이 적지 않아서다.
실제 신약개발에 소요되는 기간과 비용에 대한 R&D 생산성 연구 논문에 따르면 신약개발 R&D 생산성은 감소 추세에 있다. 지난 10년간 데이터에 따르면 신약개발에는 평균적으로 14년의 기간과 17.8억달러가 소요되는 것으로 나타났다.
다국적 제약사들의 R&D 효율성을 보더라도 신약 1개당 개발비용은 평균 30억달러 이상이 필요했다. 실제 효율성이 가장 높았던 베링거인겔하임의 경우에도 지난 10년간 R&D에 229억달러를 쏟아 부었지만 FDA 승인을 받은 신약은 7개뿐이다. 신약 1개당 32억달러의 개발비가 쓰인 셈이다.
지난 10년간 가장 많은 신약을 허가받은 노바티스의 경우 13개 신약 승인을 위해 쏟아부은 돈은 721억달러에 이른다. 신약 1개당 55억달러가 지출된 것이다. 국내사로서는 엄두가 안나는 금액이다. 다만 희망적인 건 국내사들이 바이오의약품의 제네릭이라고 할 수 있는 바이오시밀러 개발에서 두각을 보이고 있다는 점이다.
셀트리온이 개발한 바이오시밀러 3총사 ‘램시마’, ‘트룩시마’, ‘허쥬마’는 이미 유럽 시장에 성공적으로 진출했고 미국 시장에 대한 기대감도 커지고 있다. 삼성바이오에피스 역시 ‘브렌시스’, ‘렌플렉시스’, ‘삼페넷’ 등을 개발하는데 성공하며 유럽 및 해외에서 사용량을 늘려가고 있다.
업계 관계자는 “세계 의약품 시장의 중심이 바이오의약품으로 이동하면서 바이오시밀러 개발을 통해 기술력을 축적하고 있는 국내사들도 몇 년 내에 본격적인 바이오의약품 개발에 나설 것으로 기대한다”며 “앞으로는 바이오시밀러뿐만 아니라 세포치료제, 유전자치료제 등 국내사들이 도전할만한 바이오의약품 영역이 많다”고 말했다.
손인규 기자/ikson@heraldcorp.com